Анемия чёткий показатель дефицита белка в организме.
Анемия часто ассоциируется с сахарным диабетом и, как известно, усиливает риск развития связанных с диабетом микрососудистых и макрососудистых осложнений http://www.scicombinator.com/articles/3241847.
Анемия является распространенным состоянием, при котором по некоторым оценкам наблюдаются недооценка и недолеченность.
Анемия имеет как очевидные, первичные, прямые, отрицательные последствия уменьшения оксигенации тканей, так и вторичное косвенное отрицательное следствие осложнения прогрессирования многих сосуществующих заболеваний.
Симптомы анемии включают
- повышенная усталость,
- общая слабость,
- плохая переносимость стресса
- низкая работоспособность
- головокружение,
- головная боль,
- бледность/желтуха,
- тахикардия/сердцебиение,
- боль в груди,
- одышку
- резкое похолодание дистальных отделов конечностей и
- хромоту.
- ухудшение когнитивной функции, снижение концентрации внимания
- повышенная предрасположенностью к инфекциям.
Анемия часто осложняет
- сахарный диабет,
- различные виды рака,
- хронические заболевания почек,
- сердечно-сосудистые заболевания,
- гепатит С,
- ВИЧ/СПИД,
- воспалительные заболевания кишечника,
- ревматоидный артрит
- хроническая обструктивная болезнь легких (ХОБЛ).
Анемия характеризуется снижением относительного количества циркулирующих эритроцитов (массы эритроцитов) с последующей уменьшенной способностью доставлять кислород в ткани.
Всемирной Организации Здравоохранения определила стандарт анемии в 2010 Hb, более чем 120 g/l у premenopausal женщинах и 130 g /l в postmenopausal женщинах и мужчин всех возрастов.
Журнал Blood не согласился с ВОЗ и установил стандарты у белых мужчин в возрасте от 20 до 60 лет был 13,7 г/дл и после того, как 60 сократились до 13,2 г/дл, и женщины всех возрастов считались анемичными при 12,2 г/дл.
https://www.ncbi.nlm.nih.gov/pubmed/29763080
Привожу цитаты из потрясающей работы "Железный щит репродуктивного здоровья. Терапевтические стратегии при железодефицитной анемии. Информационный бюллетень / В.Е. Радзинский, Т.В. Галина, Т.А. Добрецова.
https://praesens.ru/bitrix/templates/praesens-index/assets/files/Bro/Zhelezniy%20schit_light.pdf
По оценкам экспертов, нехватка железа вносит «тихий» и зачастую непоправимый вклад в нарушение здоровья в целом. несмотря на высокую распространённость ЖДА, заболевание успешно поддаётся коррекции препаратами железа — таким образом, их неприменение следует считать очевидным дефектом медицинской помощи
Управлять этим состоянием действительно несложно. Главное — осознать все риски, которые несёт дефицит железа.
Впервые о железодефицитной анемии (ЖДА) как о проблеме мирового уровня заговорили в 1985 году. Тогда Всемирная организация здравоохранения объявила цифры: около 30% мировой популяции страдает анемией, основной причиной которой служит недостаток железа. ЖДА страдает каждая третья женщина на Земле. Данные были опубликованы в бюллетене ВОЗ с говорящим названием
«Отсутствие прогресса в снижении анемии у женщин: неудобная правда»... Во всём мире ЖДА занимает лидирующие позиции в списке 38 самых
распространённых заболеваний человечества. Следует честно признать:
несмотря на достижения современной медицины на популяционном
уровне, мы так и не смогли справиться с анемией
Согласно статистике ВОЗ, более 1,62 млрд человек во всём мире имеют ЖДА,
а свыше 3 млрд — скрытый (латентный) дефицит железа
Когда задыхаются клетки: история открытий
Самые первые описания ЖДА датированы 4000 годом до н.э.: древнегреческий
врач Меламп (Μελαμπυσ, Melampus) для лечения вернувшихся после ранений
в бою моряков использовал вино с добавлением ржавчины, соскобленной с лезвия старого ножа. Надо отдать должное древнегреческим врачам — они были близки к пониманию причин и лечению анемии, чего нельзя сказать о целителях более
позднего времени.
Так, в Средние века с заболеванием было связано много легенд и заблуждений.
К примеру, малокровных пациентов считали вампирами из-за их бледного цвета кожи. Суеверный страх окружающим добавлял тот факт, что знахари рекомендовали больным пить кровь животных, что, кстати, оказывало пусть и временный, но
лечебный эффект. Известный исследователь, ректор Лейпцигского университета
Иоганн Ланге (Johannes Lange) в XVI веке посвятил анемии целый трактат под на- званием «De Morbis Virginum» («Болезни девственниц»). По убеждению учёного,
заболевание наступало по причине задержки менархе, поэтому в качестве терапии
И. Ланге рекомендовал скорейшее вступление в брак и даже проводил инструктаж
о «лечебных свойствах» замужества. Кстати, весьма распространённые обмороки
незамужних девушек, вполне возможно, были вызваны стремлением следовать моде
носить корсет, в связи с чем юные леди попросту не доедали. Кроме того, метод
кровопускания как одна из принятых в те времена лечебных процедур также вносил свою лепту в высокую частоту анемий. Позже, в ХVII веке, анемию прозвали
хлорозом, или зелёной хворью, а в России — бледной немочью и малокровием. Все
эти термины отражали ведущие симптомы ЖДА — бледные кожные покровы,
общую слабость.
Врач XXI века все упомянутые выше методики лечения вправе назвать
в большей степени варварскими, однако и нам сегодня нечем похвастаться: на
глобальном уровне проблема анемии не решена до сих пор — как уже было сказано, Тем не менее знания о природе ЖДА продолжают накапливаться: «игроков» в патогенезе железодефицита, как оказалось, гораздо больше, чем считали ранее.
Роль железа в организме
Железо — один из самых распространённых металлов в организме человека.
Более того, ни один из организмов на Земле не может существовать без этого эссенциального элемента. К железу в составе гемоглобина присоединяется кислород — вот почему при недостатке гемоглобина организм оказывается в состоянии гипоксии, а все органы и ткани не функционируют должным образом.
Таким образом, одна из важнейших функций железа в организме — его
участие в системном транспорте кислорода гемоглобином в эритроцитах. Второй
железосодержащий белок — миоглобин — выполняет роль депо кислорода
и внутриклеточного переносчика кислорода в мышцах, где потребность в нём
часто носит моментальный и буквально взрывной характер. Миоглобин преимущественно обнаруживают в кардиомиоцитах и красных волокнах скелетных
мышц, которые должны выполнять работу в условиях аэробного метаболизма.
И тем не менее функции железа этим не ограничиваются. Так, железо
входит в состав белков, принимающих участие в базовом клеточном метаболизме: клеточном дыхании, цикле Кребса и синтезе ДНК. Кроме того, ионы
железа задействованы и в специализированных функциях, например, нейронов
и иммунной системы. Таким образом, железодефицит неблагоприятно влияет
практически на все основные метаболические процессы, включая синтез АТФ
(аденозинтрифосфат, универсальная «энергетическая валюта» клетки).
Таблица 1. Некоторые железосодержащие белки и их функции
| Процесс метаболизма | Белок | Функция |
| Транспорт кислорода | Гемоглобин | Транспорт кислорода кровью |
| Миоглобин | Транспорт кислорода и депонирование железа в мышцах | |
| Метаболизм железа | Ферритин | Депонирование железа |
| Феррохелатаза | Катализирует включение Fe2+ в протопорфирин с образованием гема | |
| Дыхательная цепь | Цитохромы | Перенос электронов на митохондриях |
| Цикл лимонной кислоты | Аконитаза | Фермент цикла трикарбоновых кислот (цикл Кребса). Важно, что в клетках, не содержащих достаточного количества железа, аконитаза утрачивает свой железосерный кластер и тогда приобретает регуляторную роль в метаболизме железа |
| Иммунная система | Миелопероксидаза | Противомикробное действие |
| Пероксидаза эозинофилов | Антипаразитарное и антибактериальное действие | |
| Лактопероксидаза | Противомикробное действие | |
| Метаболизм | NO-синтаза | Передача сигналов по нейронам, вазодилатация и иммунная защита и сигнальные процессы в нейронах |
| Гидроксилазы | Синтез нейромедиаторов и гормонов (дофамин, норадреналин, адреналин,серотонин) | |
| Метаболизм в щитовидной железе | Тиреоидная
пероксидаза |
Синтез гормонов щитовидной железы |
| Биосинтез таурина | Цистеин диоксигеназа | Синтез таурина (входит в состав жёлчных кислот и проявляет свойства нейромедиатора) |
| Антиоксидантное действие | Пероксидазы, каталаза | Окисление различных органических субстратов |
| Детоксикация | Цитохром P450 | Гидроксилирование физиологических и чужеродных веществ, таких как лекарства |
| Синтез ДНК | Рибонуклеотидредуктазы | Катализ восстановления всех четырёх рибонуклеотидов до их соответствующих дезоксирибонуклеотидов — первый шаг в синтезе ДНК |
| Биосинтез сетчатки | Ферменты расщепления каротиноидов | Биосинтез сетчатки у млекопитающих |
| Синтез простагландинов | Циклооксигеназа | Обеспечение воспалительных реакций |
Метаболизм железа в организме
Потери железа: физиологические и не очень
Обмен железа у человека примечателен высокой степенью сохранности его запасов. Нормальный мужчина теряет за год всего лишь 10% этого элемента (око- ло 1 мг/сут) 19. Две трети этого количества — через желудочно-кишечный тракт с жёлчью и в составе слущивающихся эпителиальных клеток тонкого кишечника, оставшуюся треть — с мочой и отторгнутым эпидермисом. У женщин ситуация несколько напряжённее.
Именно женщины репродуктивного возраста составляют особую группу риска, поскольку одна из важнейших причин развития ЖДА — ежемесячная физиологическая потеря железа с менструальной кровью. Так, здоровая женщина с неизменённой менструальной функцией теряет от 600 до 1200 мл крови в год, что соответствует примерно 500 мг свободного железа. За одну менструацию женщина обычно теряет железо в количестве 20–30 мг, и организм способен компенсировать такие потери до следующей менструации. Однако присоединение любого, даже незначительного провоцирующего фактора (инфекция, заболевания женской репродуктивной системы, погрешности в диете и пр.), не говоря уже о беременности, приводит к развитию ЖДА.
У беременных и лактирующих дополнительно из депо железа расходуется 800 мг и 200 мг этого элемента соответственно. Именно поэтому указанные категории выделяют в группу высокого риска. Кроме того, проблема анемии особенно злободневна для часто рожающих (более одних родов в течение 3 лет) и при многоплодной беременности.
Железо в пищевых рационах
На самом деле физиологическая потребность в железе не так уж и высока —
в сутки всего 10 мг для мужчин и 18 мг для женщин, что в условиях сбалансированной диеты соответствует 5–6 мг железа на 1000 ккал. Из них в конечном итоге
абсорбируется в кишечнике всего 1–2 мг элемента
Поскольку организм человека не имеет механизмов активной экскреции
железа, всю «ответственность» за системную концентрацию
эссенциального элемента берут на себя энтероциты верхних отделов
тонкого кишечника на этапе абсорбции железа из пищи
Железо, поступающее с пищей, представлено двумя вариантами.
1. Гемовое (Fe2+) содержится в мясе, рыбе и птице. Оно в высшей степени
биодоступно, и, несмотря на небольшое содержание в рационе, его доля в общем
количестве абсорбированного железа достаточно велика. Особую усвояемость
гемовому железу придаёт белковое окружение — именно оно гарантирует плавность и равномерность поступления элемента в организм.
2. Негемовое (Fe3+) входит в продукты растительного происхождения и составляет большую часть железа в пищевом рационе (более 90%). Его биодоступность, в отличие от гемового железа, в значительной степени зависит от наличия
подавляющих или усиливающих факторов.
Так, фитаты, оксалаты, полифенолы, кальций, различные белки молока, яиц, сои и некоторые препараты подавляют абсорбцию негемового железа, тогда как витамин С, наоборот, усиливает её.
Таким образом, количество абсорбируемого железа в полной мере зависит от
характера и количества потребляемой пищи.
«Железный» круговорот
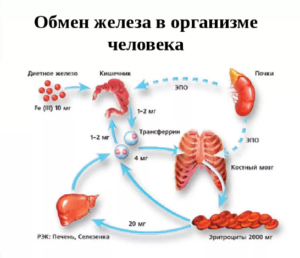 Удивительно, но организм человека не имеет механизмов активной экскреции железа, а потому всю «ответственность» за его количество на себя берут интестинальные клетки на этапе всасывания (теряется только десятая часть этого элемента с жёлчью и слущивающимися кишечными эпителиоцитами). При падении концентрации железа в организме ниже критического уровня энтероциты ворсинок тонкого кишечника получают сигнал «бедствия», в результате чего стартует абсорбция железа. Из просвета двенадцатиперстной кишки железо попадает в цитоплазму энтероцита. Важно, что мембрана кишечных эпителиоцитов специализирована только на транспорт двухвалентного (гемового) железа, ионы которого тут же подхватываются белками-переносчиками, такими как дуоденальный металлотранспортёр (ДMT-1). Этот фермент, называемый переносчиком двухвалентных металлов, доставляет и другие ионы, например цинка, поэтому при дефиците ДMT-1 захват железа может быть нарушен.
Удивительно, но организм человека не имеет механизмов активной экскреции железа, а потому всю «ответственность» за его количество на себя берут интестинальные клетки на этапе всасывания (теряется только десятая часть этого элемента с жёлчью и слущивающимися кишечными эпителиоцитами). При падении концентрации железа в организме ниже критического уровня энтероциты ворсинок тонкого кишечника получают сигнал «бедствия», в результате чего стартует абсорбция железа. Из просвета двенадцатиперстной кишки железо попадает в цитоплазму энтероцита. Важно, что мембрана кишечных эпителиоцитов специализирована только на транспорт двухвалентного (гемового) железа, ионы которого тут же подхватываются белками-переносчиками, такими как дуоденальный металлотранспортёр (ДMT-1). Этот фермент, называемый переносчиком двухвалентных металлов, доставляет и другие ионы, например цинка, поэтому при дефиците ДMT-1 захват железа может быть нарушен.
Трёхвалентное (негемовое) железо, прежде чем попасть на ДMT-1, восстанавливается до двухвалентного состояния с помощью цитохрома B. В цитоплазме энтероцита ионы Fe2+ соединяются с другим транспортным белком —ферропортином, который передаёт ионную «эстафету» дальше. На следующем этапе — при транспорте из энтероцита в кровеносное русло — двухвалентное железо переходит с помощью гефестина снова в трёхвалентную форму. Ионы Fe3+, подхваченные апотрансферрином, образуют новое соединение — трансфер- рин, в составе которого поступают по системе воротной вены в печень, костный мозг и во все клетки, где проходят синтетические реакции с участием железа.
Трансферрин — важный участник метаболизма железа, именно поэтому он выступает одним из значимых диагностических маркеров дефицита этого эссенциального элемента. Важный практический вывод состоит в том, что препараты двухвалентного железа, особенно в виде простых солей, способны слишком активно поступать в энтероцит и дальше в кровь, поскольку «обходят» дополнительный ферментный барьер энтероцита. А это обусловливает риск токсических реакций даже при наличии анемии.
Ионы железа обладают высоким редокс-активным потенциалом, то есть могут участвовать как в окислительных, так и в восстановительных реакциях. Именно поэтому во избежание окислительного стресса железо, не участвующее в метаболизме, откладывается «про запас» — депонировано в цитоплазме клеток (в основном печени и селезёнки) в составе ферритина. В целом кишечные энтероциты абсорбируют железо до тех пор, пока не произойдёт насыщение им организма, после чего всасывание снижается или прекращается вовсе. Долгое время не было понятно, какой белок выступает главным гуморальным регулятором метаболизма железа. В качестве возможных кандидатов рассматривали ферритин, трансферрин и даже трансферриновые рецепторы. Было установлено, что активность эритропоэза сама по себе оказывает влияние на захват железа в кишечнике, а более поздние исследования показали, что роль независимого регулятора абсорбции железа выполняет гипоксия. Однако совсем недавно учёные пришли к заключению, что универсальный регулятор «железного» метаболизма — белок гепсидин, влияющий как на абсорбцию поступающего с пищей элемента, так и на его высвобождение из макрофагов при утилизации стареющих эритроцитов. Любопытно, но именно этот белок называют одним из перспективных маркеров для диагностики как латентного, так и манифестного железодефицита.
Несмотря на сложнейшие механизмы всасывания железа в кишечнике, основную часть элемента организм получает за счёт системной рециркуляции путём
возвращения ионов металла из стареющих эритроцитов, когда в конце периода
их жизни на клеточной мембране происходят биохимические изменения, которые
стимулируют фагоцитарную активность макрофагов селезёнки. Поглотив красное
тельце, макрофаг «разбирает» его на части: что нужно — используется повторно,
а то, что «в отходы», — утилизируется. Гемоглобин распадается на две составляющие
— гем (соединение порфирина и ионов железа) и белки.
Железное убийство клеток
Интересно, что для любой состарившейся клетки апоптоз — «самоубийство» — своего рода «кодекс чести» и самый что ни на есть физиологичный процесс. Так, у многоклеточных, например у человека, клеточная гибель представляет собой «акт альтруизма» в интересах целого организма. Всего открыто более десятка механизмов
клеточной смерти, самый известный из которых — апоптоз.
В 2012 году учёные обнаружили ещё одну разновидность клеточной гибели
— ферроптоз, разрушение посредством присоединения ионов железа
к мембране клеток. Ввиду своей высокой химической активности присутствие
железа в свободном, не связанном с ферритином состоянии оказывают негативное
воздействие на клетки. По своей природе ферроптоз направлен на уничтожение раковых клеток и отживших своё фибробластов. Однако при избыточном
поступлении железа его ионы превращаются в свободные радикалы с мощным повреждающим действием на все окружающие ткани. Таким образом, при назначении препаратов железа так важно «не перестараться», помня о том, что выражение «золотая середина» в приложение к концентрации железа оправдывает себя как нельзя лучше.
Ферритин: маркер «железного» неблагополучия
Молекула ферритина состоит из двух десятков субъединиц, образующих глобулу
с большой впадиной, где может поместиться до 4 тыс. (!) молекул трёхвалентного железа. Столь универсальный «накопитель» железа не мог не вызвать интереса
разработчиков лекарственных средств в плане прообраза новых препаратов, и та- кие средства уже существуют.
Формирование железодефицита — процесс постепенный. Если организм получает недостаточное количество железа, он в первую очередь использует «стратегический запас» — из соединений с ферритином. Логичным продолжением будет следующая клиническая картина: гемоглобин в норме, а вот концентрация ферритина в крови начнёт уменьшаться. Если на этом этапе не принять никаких терапевтических мер по восполнению поступления экзогенного железа, то его запасы в организме закономерно истощаются, поскольку его ионы постоянно участвуют в биохимических реакциях.
Следующим этапом закономерно становится развитие железодефицитного эритропоэза: необходимого количества железа для включения в гемовую часть эритроцитов нет, поэтому существенно страдает кроветворная функция костного мозга.
В результате концентрация гемоглобина снижается, а вот количество протопорфирина в эритроцитах увеличивается. Уровень трансферрина в крови также закономерно
падает, поскольку функция транспортных белков не востребована — попросту нечего транспортировать.
Развёрнутая стадия тяжёлой формы железодефицита — ЖДА — сопровождается выраженным снижением концентрации и ферритина, и трансферрина в крови.
Состояние железодефицита в большинстве случаев имеет прогрессирующее течение именно в сторону утяжеления. Вот почему для практикующего врача важно
уметь распознать ЖДА ещё на стадии её зарождения, и для этого нужно понимать
биохимические закономерности развития ЖДА.
Диагностика железодефицита и ЖДА
Концентрация гемоглобина: нюансы
Как известно, клинический диагноз анемии устанавливают по уровню гемоглобина. При этом для практикующего врача чрезвычайно важно дифференцировать разновидности анемии, которая может быть обусловлена дефицитом не только железа,
но и фолиевой кислоты, витамина B12, а также иметь смешанную этиологию. Не
менее значимым этиологическим фактором может выступать хроническая инфекция
(продукты воспаления и токсины бактерий оказывают на костный мозг подавляющее влияние). Не следует игнорировать и вероятность манифестации в виде анемии
острого или хронического лейкоза. Хотя, безусловно, именно ЖДА — наиболее
распространённая причина снижения концентрации гемоглобина в крови. Последняя,
кстати, по современным представлениям, не столь проста в интерпретации.
Информационная система о содержании витаминов и минералов в продуктах
питания (Vitamin and Mineral Nutrition Information System, VMNIS), одна из
подведомственных Всемирной организации здравоохранения служб, в 2011 году опубликовала данные о концентрации гемоглобина при диагностике анемии.
Согласно предложенной терминологии VMNIS, исключённый термин «лёгкая степень тяжести» в отношении ЖДА не вполне уместен, поскольку анемия возникла на фоне
уже имеющегося и прогрессирующего железодефицита. Недостаток железа в организме всегда имеет последствия даже при отсутствии клинических проявлений заболевания.
VMNIS обращает внимание, что распространён ность анемии у людей, живущих в горах, и среди курильщиков может быть недооценена при использовании стандартных предельных значений при анемии.
К заболеваниям с хроническим воспалением относят:
• болезни почек;
• инфекционно-воспалительные заболевания органов дыхания;
• урогенитальные инфекции (хламидийная, трихомонадная, уреаплазменная)
и дисбиозы влагалища (баквагиноз, кандидозный вульвовагинит);
• вирусную инфекцию (герпетическая, цитомегаловирусная, ВИЧ, гепатиты);
• аутоиммунные болезни;
• злокачественные новообразования и т.п.
Войны за железо
Ещё одна причина, почему концентрация железа должна быть под жёстким контролем,
обусловлена тем, что устойчивость к инфекциям отчасти зависит от результатов
«войны за железо» между человеком и атакующими его бактериями.
Железо необходимо микроорганизмам так же, как и человеку, для нормального функционирования и развития, поэтому многие бактерии «разработали» целый арсенал ухищрений для получения этого металла из сред (например, организма человека), где элемент в свободном состоянии содержится в небольших концентрациях. К таким механизмам относят синтез железосвязывающих
органических молекул (сидерофоров) и их обратный захват. Некоторые патогены даже умеют отщеплять ионы железа от гемоглобина, трансферрина и лактоферрина. Зависимость иммунитета от присутствия ионов железа подтверждена наблюдениями. Бактериостатическое действие лактоферрина в качестве первой линии противоинфекционной защиты обусловлено высокой аффинностью его молекулы к ионам Fe3+. Забирая железо у патогенных микроорганизмов, лактоферрин попросту убивает бактерии.
Выбор препарата — кажущаяся простота
Препараты железа в зависимости от пути введения в организм подразделяют на пероральные и парентеральные (последние правомерно использовать только
в случае наличия серьёзных показаний, например в случае ЖДА тяжёлой степени). Дальнейшее разделение препаратов железа проводят по другому признаку: в
зависимости от химического состава они могут быть простыми (например, сульфат
железа [II], глюконат железа [II], лактат железа [II], фумарат железа [II]) и комбинированными, в состав которых дополнительно входят другие вещества (аскор- биновая кислота, фолиевая кислота, витамин В12, микроэлементы). Особняком
стоит группа препаратов на основе железа (III) гидроксид полимальтозного комплекса.
Долгие годы назначение солевых препаратов железа считали «золотым стандартом» лечения ЖДА. Однако многочисленные исследования показали, что
сульфаты железа нередко вызывают побочные эффекты, которые можно объяснить законами «железного» метаболизма. Во-первых, абсорбция двухвалентного
железа из солевых препаратов происходит за счёт пассивной диффузии, что
представляет собой неконтролируемый организмом процесс, а это прежде всего
увеличивает риск передозировки железа, которая грозит самым настоящим отравлением с поражением внутренних органов и может привести даже к полиор ганной недостаточности.
Соли двухвалентного железа поступают в организм путём как активного
механизма, так и пассивной абсорбции, а это заведомо может создать условия
для перенасыщения железом. Высокая концентрация железа в сыворотке крови
может повлечь за собой перенасыщение трансферрина и появление свободных
ионов железа. Железо, не связанное с трансферрином, поступает в сердце, печень и ткани эндокринной системы и, вызывая окислительный стресс, губительно действует на ткани органов. Во-вторых, диссоциация солей железа происходит в просвете ЖКТ, и сами
по себе сульфаты оказывают раздражающее действие на его слизистую оболочку.
Как результат — диспептические симптомы: чувство переполнения желудка, тошнота, рвота, запоры или диарея. Кроме того, возможный избыток ионов железа
в не связанном с ферритином состоянии способствует оксидативному стрессу. Его
последствия — прямое повреждающее действие на клетки, прежде всего печени.





Супер!!!Замечательная статья!!!Раушан Турсуновна,молодец!!!Я эту статью распечатаю и подарю гинекологу,она подписалась в мою структуру!!!Она говорит,у меня все беременные голодные!!!Есть много врачей,которые это понимают!!!Многие не дооценивают роль белка!!!